临床试验运行管理制度
发表时间:2014年12月20日
|
起草人 |
田淑艳 |
审核人 |
艾德华 |
批准人 |
唐立峰 |
|
日 期 |
2014-7-10 |
日 期 |
2014-7-15 |
日 期 |
2014-7-20 |
|
页 数 |
6 |
颁布日期 |
2014-8-1 |
起效日期 |
2014-8-1 |
一、 目 的
明确药物临床试验机构的组织构架及运行管理制度,规范药物临床试验过程,保证临床试验工作程序科学、周密、规范,保护受试者的权益并保障其安全。
二、 范 围
适用于本院开展的所有药物临床试验。
三、 内 容
1. 人员组成
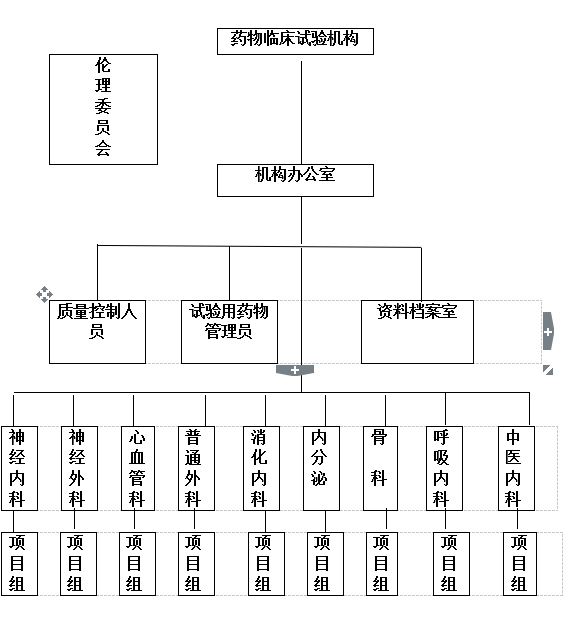
药物临床试验机构下设机构办公室、资料室、档案室、呼吸、心血管、消化、内分泌、中医、骨科、神外、神内、普外、麻醉、血液、妇科、肾内、肿瘤专业组。机构办公室负责日常事务,协调相关部门之间的关系,对项目承接和运行情况进行监督管理。
² 药物临床试验机构设置机构主任1名,由医院直接任命;
² 设置机构办公室主任1名,由机构主任任命。机构办公室主任对机构主任负责,协助主任对机构进行管理;
² 设置专职秘书1名,协助机构办公室主任管理日常工作;
² 设置质量管理员3名;
² 设置资料管理员2名;
² 设置药物管理员2名,其中一名为专职;
² 药物临床试验专业组负责人由医院任命;
² 各药物临床试验专业组组建研究团队。
2. 药物临床试验由药物临床试验机构(以下简称本机构)负责组织实施,由机构办公室负责项目准入审查,未经同意不得开展。
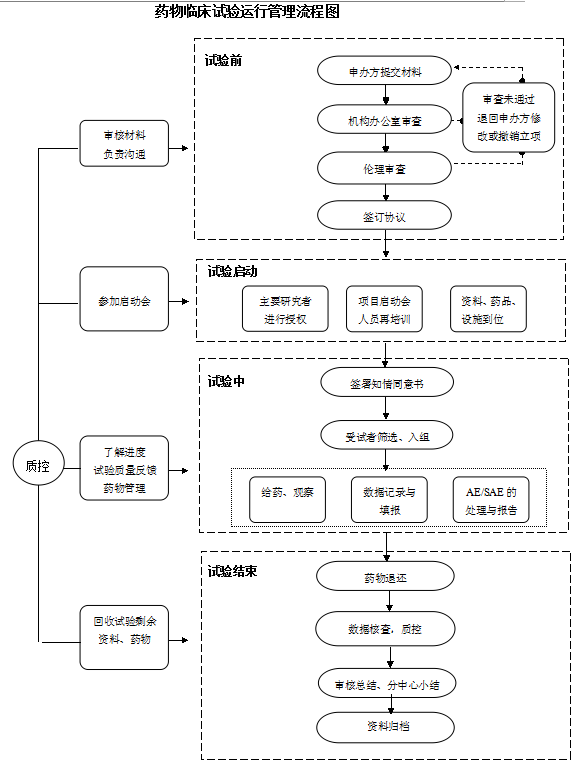
3. 试验启动前
1) 申办者与机构办公室联系,秘书负责接待;
2) 机构办公室主任与专业组负责人共同讨论是否同意负责或参加该项药物临床试验,对在研项目数量超过3项或相同类型试验及项目完成质量欠佳的专业组原则上不同意承接新项目;
3) 临床试验申请与批准
² 机构办公室秘书形式审查专业组提交的《临床试验申请表》,报机构办公室主任审核及机构秘书签字批准后承接该项试验;
4) 试验协议的签订
² 项目获得药物临床试验伦理委员会同意后,机构主任负责签署临床试验协议,具体参照《合同管理制度》;
² 协议签署后,机构办公室为该研究项目建立项目编号、建档,按要求保存该药物临床试验各种相关的资料文件;
² 申办方按协议规定支付首笔研究经费;
5) 机构办公室向专业科室及其他相关科室下达《临床试验启动通知》,原件保存在相应的项目文件档案中。
4. 试验进行中
1) 参加项目启动会议,了解试验方案和流程,熟悉临床研究团队,明确责任分工;
2) 试验用药物由申办者送达或快递到机构,机构办公室药品管理员及申办者共同清点和交接无误后由机构药品管理员送往项目科室进行清点,具体参照《药物管理制度》;
3) 督促及检查研究者按照GCP、试验方案和标准操作规程开展试验;
4) 临床试验过程中如发生严重不良事件,各专业组应在获知后24小时内上报机构办公室及伦理委员会办公室,并由机构办公室上报药品监督管理部门、卫生行政部门以及申办者和组长单位;
5) 研究者负责协调受试者的抢救;
6) 临床试验因各种原因中止或中断,研究者应及时报告机构办公室,并按中止临床试验项目的要求完善相关手续。
5. 试验结束
1) 机构药品管理员将所有剩余药物及空包装退回申办方;
2) 申办者按协议规定支付剩余临床试验费用。机构办公室按照《财务管理制度》进行临床试验费用的分配。
3) 机构办公室和主要研究者负责对试验资料及数据的科学性、真实性和完整性进行核查,研究者应尽快回复统计单位有关数据方面的疑义;
4) 项目总结报告或小结报告经主要研究者及机构办公室审核,具体参照《临床试验结束的标准操作规程》;
5) 机构办公室下达《临床试验结束通知》;
6) 研究者将全部试验档案资料整理汇总完善后移交机构办公室。机构办按照《文件资料管理制度》将该临床试验过程中的相关文件、资料归档。
6. 试验过程中的质量控制及反馈
1) 临床试验期间,机构办公室每个月与专业组质控员联系,协调处理试验中出现的问题;
2) 配合监查,机构办公室每月与项目监查员联系,沟通反馈监查中发现的问题;
3) 机构参照《临床试验质量控制管理制度》对临床试验过程进行质量控制;
4) 临床试验期间,试验方案及知情同意书如有修改,必须通过伦理委员会审查和批准;
5) 接受稽查和药品监督管理部门的视查;
四、 参考资料
1. 《药品注册管理办法》,国家食品药品监督管理总局,2007.10.01
2. 《药物临床试验质量管理规范》,国家食品药品监督管理总局,2003.08.06
3. 《药物临床试验机构资格认定办法(试行)》,国家食品药品监督管理总局,2004
4. ICH-GCP
五、 工作表格
1. 《临床试验申请表》(文件编号:JG-form-001-3.0)
2. 《临床试验启动通知》(文件编号:JG-form -002-1.0)
3. 《临床试验结束通知》(文件编号:JG-form -003-3.0)
4. 《药物临床试验研究者简历》(文件编号:JG-form -038-3.0)
六、 附 件
附件1 药物临床试验机构组织结构图
附件2 机构人员分工
附件3 药物临床试验运行管理流程图
附件1
药物临床试验机构组织结构图
附件2 机构人员分工
1 药物临床试验机构主任: 唐立峰 ;
2 药物临床试验机构办公室主任: 艾德华 (全职);
3 药物临床试验机构秘书: 田淑艳 (全职);
4 药物临床试验机构质量管理员: 王远威 何军 王硕 ;
5 药物临床试验机构资料管理员: 何军 宫里娜 ;
6 药物临床试验机构药品管理员: 王远威 孙睿 (全职);
7 各专业组负责人
1) 内分泌专业组负责人: 孙丽 ;
2) 心血管内科专业组负责人: 王建中 ;
3) 消化内科专业组负责人: 孙亚新 ;
4) 呼吸内科专业组负责人: 张春雨 ;
5) 骨科专业组负责人: 曲志国 ;
6) 神经内科专业组负责人: 郭立斌 ;
7) 神经外科专业组负责人: 常志田 ;
8) 普外科专业组负责人: 傅继宁 ;
9) 中医内科专业组负责人: 朱瑞生 ;
附件3